La Química Orgánica
Jue, 10/09/2009 - 18:25
¿Qué es la química orgánica?
La química orgánica es la química del carbono y de sus compuestos.
Importancia de la química orgánica
Los seres vivos estamos formados por moléculas orgánicas, proteínas, ácidos nucleicos, azúcares y grasas. Todos ellos son compuestos cuya base principal es el carbono. Los productos orgánicos están presentes en todos los aspectos de nuestra vida: la ropa que vestimos, los jabones, champús, desodorantes, medicinas, perfumes, utensilios de cocina, la comida, etc.
Desarrollo sostenible y la química organica
Los productos orgánicos han mejorado nuestra calidad y esperanza de vida. Podemos citar una familia de compuestos que a casi todos nos ha salvado la vida, los antibióticos. En ciertos casos, sus vertidos han contaminado gravemente el medio ambiente, causado lesiones, enfermedades e incluso la muerte a los seres humanos. Fármacos como la Talidomida, vertidos como el de Bhopal en la India ponen de manifiesto la parte más negativa de de la industria química.
La Química Orgánica estudia aspectos tales como:
- Los componentes de los alimentos: carbohidratos, lípidos, proteínas y vitaminas.
- Industria textil
- Madera y sus derivados
- Industria farmacéutica
- Industria alimenticia
- Petroquímica
- Jabones y detergentes
- Cosmetología
2.1
CARACTERISTICAS DEL CARBONO.
El átomo de carbono
Siendo el átomo de carbono la base estructural de los compuestos orgánicos, es conveniente señalar algunas de sus características.
Característica
| |
Número atómico
|
6
|
Configuración electrónica
| |
Nivel de energía más externo (periodo)
|
2
|
Electrones de valencia
|
4
|
Masa atómica promedio
|
12.01 g/mol
|
Propiedades físicas
|
Es un sólido inodoro, insípido e insoluble en agua
|

El carbono posee unas caracteristicas especiales, que juntas lo hacen unico dentro del sistema periodico, por lo que es el elemento base de todos los compuestos organicos:
. Electronegatividad intermedia por lo que puede formar enlace covalente tanto con metales como con no metales.
2. Tetravalencia: sp2 Ë s px py pz ; ƒ¢H = .400 kJ/mol (se desprenden 830 kJ/mol al formar 2 enlaces C.H) lo que ofrece la posibilidad de unirse a si mismo for-mando cadenas.
. Ademas, tiene un tamano pequeno lo que posibilita la formacion de enlaces do-bles y triples, ya que es posible que los atomos se aproximen lo suficiente para formar enlaces gƒÎh, lo que no es posible en el Si.
Ejemplo (Selectividad. Madrid Junio 98).
Al quemar 2,34 g de un hidrocarburo se forman 7,92 g de dioxido de carbono y 1,62 g de vapor de agua. En condiciones normales, la densidad del hidrocarburo gaseoso es 3,48 g x l.1; a) Determine la masa molecular y formula de dicho hidrocarburo; b) .Que vo-lumen de oxigeno gaseoso a 85oC y 700 mm de presion, se necesita para quemar total-mente los 2,34 g de este hidrocarburo? Datos: Masas atomicas: O = 16,0 y C = 12.
a) CHab + (a + b/4) O2 ¨ a CO + (b/2) HO 22(12 ) (/4) 44 9 2,34 7,92 1,62++===abgabmolagbggng
2.1 Hibridación
La hibridación es un fenómeno que consiste en la mezcla de orbítales atómicos puros para generar un conjunto de orbítales híbridos, los cuales tienen características combinadas de los orbítales originales.

La configuración electrónica desarrollada para el carbono es:


 |
Estos orbítales son idénticos entre si, pero diferentes de los originales ya que tienen características de los orbítales “s” y “p”.combinadas. Estos son los electrones que se comparten. En este tipo de hibridación se forman cuatro enlaces sencillos.

 |
El átomo de carbono forma un enlace doble y dos sencillos.
Hibridación sp
En este tipo de hibridación sólo se combina un orbital “p” con el orbital “s”.Con este tipo de hibridación el carbono puede formar un triple enlace.
El tipo de hibridación determina la geometría molecular la cual se resume en el siguiente cuadro.

2.2 Geometria lineal: angulos C.H: 180 o y distancia CßC < C=C < C.C .CßN Ejemplo: HCßCH, CH3
Ejercicio A:
Indica la hibridacion que cabe esperar en cada uno de los atomos de carbono que partici-pan en las siguientes moleculas: CHßC.CH.CH=CH.CßN 2 .CHO; CH. 3
NOMENCLATURA DE COMPUESTOS ORGANICOS CON MAS DE UN GRUPO FUNCIONAL.
Para nombrar compuestos organicos con mas de un grupo funcional, se identifica cual es la funcion principal (la primera en el orden de prioridad de la tabla siguiente). Es la que da el nombre al compuesto.
Las funciones secundarias se nombran como prefijos usando el nombre del grupo que aparece en la ultima columna (goxoh para carbonilo, ghidroxih para hidroxilo).
Principales grupos funcionales (por orden de prioridad)
2.3

2.4
Hidrocarburos simples
Como ya dijimos, los hidrocarburos simples son compuestos orgánicos que sólo contienen carbono e hidrógeno. Estos hidrocarburos simples vienen en tres variedades (llamadas alcanos, alquenos y alquinos) dependiendo del tipo de enlace carbono-carbono (sencillo, doble o triple) que ocurre en la molécula.
Alcanos
Los alcanos son la primera clase de hidrocarburos simples y contienen sólo enlaces sencillos de carbono-carbono. Para nombrarlos, se combina un prefijo, que describe el número de los átomos de carbono en la molécula, con la raíz que termina en“ano”.
He aquí los nombres y los prefijos para los primeros diez alcanos.
| Átomos de carbono |
Prefijo
|
Nombre de alcanos
|
Fórmula Química
|
Fórmula semidesarrollada
|
1
|
Meth
|
Metano
|
CH4
|
CH4
|
2
|
Eth
|
Etano
|
C2H6
|
CH3CH3
|
3
|
Prop
|
Propano
|
C3H8
|
CH3CH2CH3
|
4
|
But
|
Butano
|
C4H10
|
CH3CH2CH2CH3
|
5
|
Pent
|
Pentano
|
C5H12
|
CH3CH2CH2CH2CH3
|
6
|
Hex
|
Hexano
|
C6H14
|
CH3CH2CH2CH2 CH2CH3
|
7
|
Hept
|
Heptano
|
C7H16
|
CH3CH2CH2CH2CH2CH2CH3
|
8
|
Oct
|
Octano
|
C8H18
|
CH3CH2CH2CH2CH2CH2CH2CH3
|
9
|
Non
|
Nonano
|
C9H20
|
CH3CH2CH2CH2CH2CH2CH2CH2CH3
|
10
|
Dec
|
Decano
|
C10H22
|
CH3CH2CH2CH2CH2CH2CH2CH2CH2CH3
|
La fórmula química para cualquier alcano se encuentra en la expresión CnH2n + 2, donde n es el número de carbonos que se enlazan.
Ejemplo para un alcano que tenga seis carbonos (un hexano):
CnH2n + 2
Reemplazamos n por el seis y tenemos
C6H2(6) + 2
C6H12 + 2
C6H14
que según su fórmula semidesarrollada es CH3CH2CH2CH2CH2CH3
La fórmula semidesarrollada, para los primeros diez alcanos de la tabla, muestra cada átomo de carbono y los elementos a los que están unidos.
Los alcanos simples comparten muchas propiedades en común. Todos entran en reacciones de combustión con el oxígeno para producir dióxido de carbono y agua de vapor. En otras palabras, muchos alcanos son inflamables. Esto los convierte en buenos combustibles. Por ejemplo, el metano es el componente principal del gas natural y el butano es un fluido común más liviano.
Alquenos
La segunda clase de hidrocarburos simples son los alquenos, formados por moléculas que contienen por lo menos un par de carbonos de enlace doble.
| Eteno, dos carbonos con enlace doble. |
Para nombrarlos, los alquenos siguen la misma convención que la usada por los alcanos. Un prefijo (para describir el número de átomos de carbono) se combina con la terminación “eno” para denominar un alqueno (no puede haber un meteno ya que tendría solo un átomo de carbono). El eteno (que sería el primer alqueno), por ejemplo, consiste de dos moléculas de carbono unidas por un enlace doble.
La fórmula química para los alquenos simples sigue la expresión CnH2n. Debido a que uno de los pares de carbono está doblemente enlazado, los alquenos simples tienen dos átomos de hidrógeno menos que los alcanos.
Alquinos
| Etino, dos carbonos con enlace triple. |
Los alquinos son la tercera clase de hidrocarburos simples y son moléculas que contienen por lo menos un par de enlaces de carbono, que en este caso será triple. Tal como los alcanos y alquenos, los alquinos se denominan al combinar un prefijo (que indica el número de átomos de carbono) con la terminación “ino” para denotar un enlace triple.
La fórmula química para los alquinos simples sigue la expresión CnH2n-2.
Isómeros
Ya que el carbono puede enlazarse de tantas diferentes maneras, una simple molécula puede tener diferentes configuraciones de enlace.
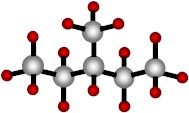
Como ejemplo de tal afirmación, veamos las dos moléculas siguientes:
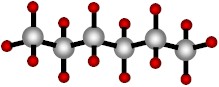
CH3CH2CH2CH2CH2CH3
| 
| |||||||||
| C6H14 | C6H14 | |||||||||
Ambas moléculas tienen formulas químicas idénticas (C6H14), sin embargo sus fórmulas desarrolladas y estructurales (y, por consiguiente, algunas propiedades químicas) son diferentes. Estas dos moléculas son llamadas isómeros.
Los isómeros son moléculas que tienen la misma fórmula química, pero diferentes fórmulas desarrolladas y estructurales.
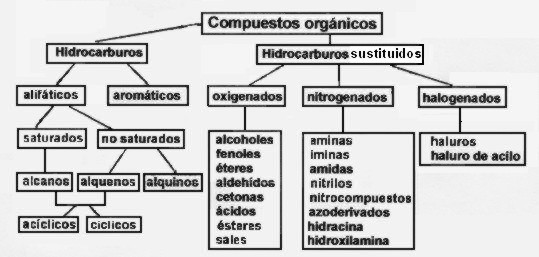
Clasificación de los compuestos orgánicos
Como ya dijimos, los hidrocarburos, formados solo por carbono e hidrógeno, son los compuestos orgánicos más simples en su composición, por ello es que se pueden tomar como base para hacer una clasificación de los compuestos orgánicos.
Si en un hidrocarburo sustituimos uno o más átomos de hidrógeno por otro átomo o agrupación de átomos podemos generar todos los tipos de compuestos orgánicos conocidos. Por ejemplo, si en un alcano (hidrocarburo saturado) sustituimos un átomo dehidrógeno por un halógeno obtendremos un derivado halogenado, y si en un alcano sustituimos dos átomos de hidrógeno por uno de oxígeno podemos general un aldehído (si la sustitución ocurre en un átomo de carbono terminal) o una cetona (si la sustitución se hace en un carbono intermedio).
Entendido esto, podemos clasificar los compuestos orgánicos en hidrocarburos e hidrocarburos sustituidos.
 |
Si la sustitución de átomos de hidrógeno en los hidrocarburos se hace con átomos de oxígeno, hablaremos de compuestos oxigenados o funciones oxigenadas (alcoholes, fenoles, éteres, aldehídos, cetonas, ácidos, ésteres, sales).
Si la sustitución de átomos de hidrógeno en los hidrocarburos se hace con átomos de nitrógeno, hablaremos de compuestos nitrogenados o funciones nitrogenadas.
Lo puedes ver en:
http://fresno.pntic.mec.es/~fgutie6/quimica2/ArchivosPDF/09Qu%EDmicaOrg%E1nica.pdf
http://www.google.co.cr/imgres?hl=es-419&sa=X&biw=1366&bih=705&tbm=isch&prmd=imvns&tbnid=UiITiRIx0EGC2M:&imgrefurl=http://cervex-cienciasmedicas.blogspot.com/2011/05/grupos-funcionales-radicales.html&docid=l1DB2ADVyTqeZM&imgurl=https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhGNV3c0buL5HleHk_8ZA3Zlx2DI76pvp1E_PtmnIPgxf4Fniztd4FOsB8ht4XszRuoWHT3TRjC7sa6hqnaVrAxdqzMBW5qfr6cIlzLFCFwIdziIKqtWokD_-r3e7raqokEjVzBWtTrGFL9/s1600/cuadro%252Bgrupos%252Bfuncionales.jpg&w=945&h=690&ei=FHcmUPCuLaS_0QGZ1oHIBQ&zoom=1&iact=hc&vpx=301&vpy=400&dur=727&hovh=192&hovw=263&tx=151&ty=130&sig=117989446987960098527&page=1&tbnh=146&tbnw=200&start=0&ndsp=18&ved=1t:429,r:13,s:0,i:111
http://www.profesorenlinea.cl/Quimica/grupos_funcionales.html
http://genesis.uag.mx/edmedia/material/quimicaII/qorg.cfm
http://www.youtube.com/watch?v=uvMW_uRuJ2o
http://www.youtube.com/watch?v=7OtBGyfrYpM